
能斯特方程式(Nernst equation)
根據能斯特方程式,在化學反應中
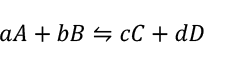
電位與反應平衡狀態關係為
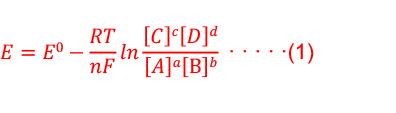
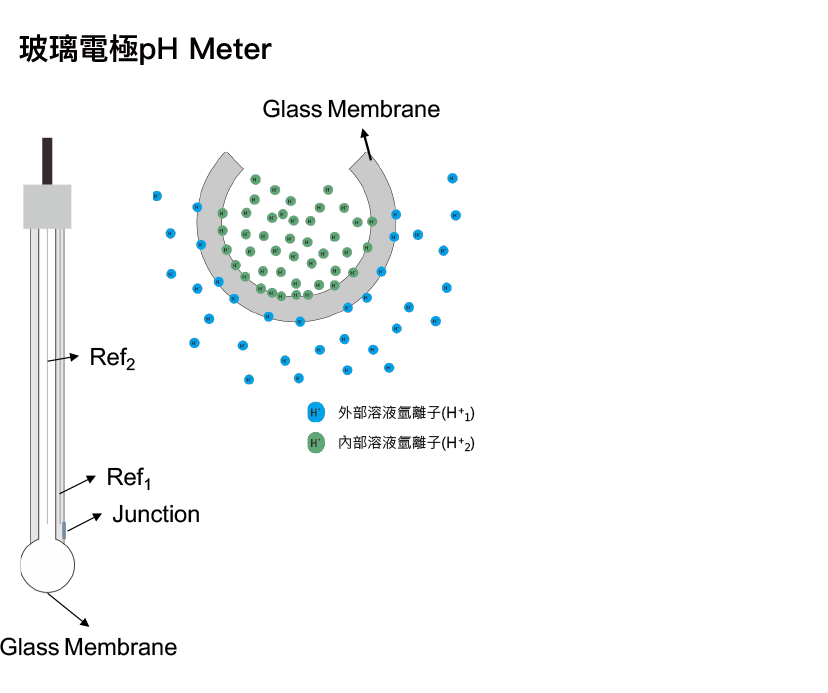
pH meter玻璃電極的方程式可表示為:

其中玻璃電極內外層分別與玻璃電極內部及外部溶液進行氫離子交換,並量測其電位E1 & E2

透過量測內外玻璃膜電位差(Eb)與pH值作圖,可得以下關係式:

透過量測內外玻璃膜電位差(Eb)與pH值作圖,可得以下關係式:
由於玻璃薄膜使用後表面可交換氫離子含量發生變化,以及內部溶液氫離子濃度改變,方程式中𝐸𝑘′數值會改變,進而產生誤差,因此玻璃電極使用前皆須進行校正
依照能斯特方程式,在化學反應中
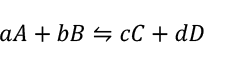
依照能斯特方程式,在化學反應中
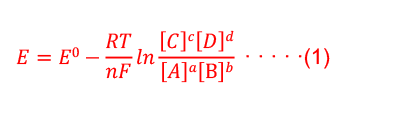
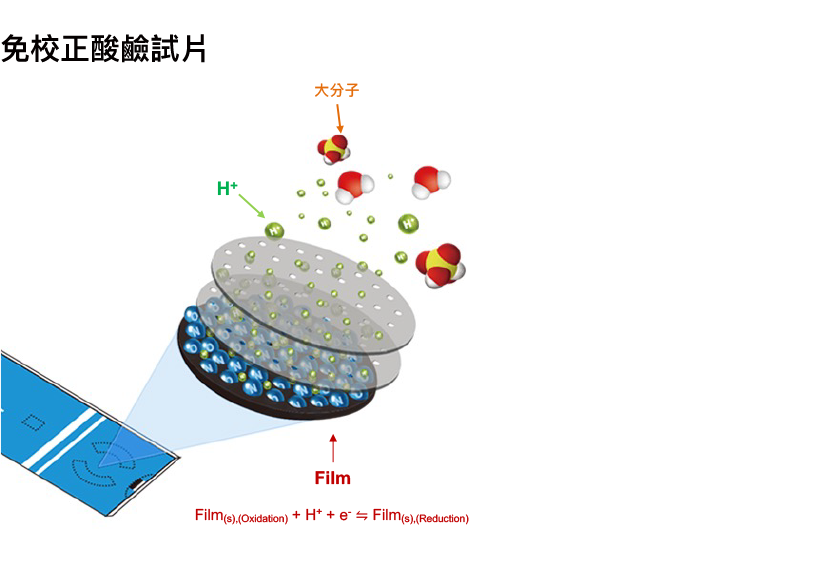
Humming Probe酸鹼檢測試片將氫離子吸附薄膜修飾於試片表面,其薄膜與溶液中氫離子發生氧化還原反應,方程式可表示為:
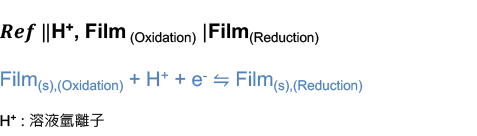
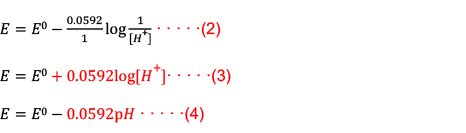
根據能斯特方程式,可將電位表示為
我們的產品
Products
文章列表
Articles
Subscribe us












